Kit di rilevamento degli acidi nucleici del virus del vaiolo delle scimmie (MPV) Testsealabs
INTRODUZIONE
Il kit viene utilizzato per la rilevazione qualitativa in vitro di casi sospetti di virus del vaiolo delle scimmie (MPV), casi raggruppati e altri casi che devono essere diagnosticati per l'infezione da virus del vaiolo delle scimmie.
Il kit viene utilizzato per rilevare il gene f3L dell'MPV nei tamponi faringei e nei campioni di tamponi nasali.
I risultati dei test di questo kit sono solo a scopo di riferimento clinico e non devono essere utilizzati come unico criterio per la diagnosi clinica. Si raccomanda di condurre un'analisi completa della condizione in base al quadro clinico del paziente.
manifestazioni e altri esami di laboratorio.
Uso previsto
| Tipo di analisi | tamponi faringei e tamponi nasali |
| Tipo di test | Qualitativo |
| Materiale di prova | PCR |
| Dimensioni della confezione | 48 test/1 scatola |
| Temperatura di conservazione | 2-30℃ |
| Durata di conservazione | 10 mesi |
CARATTERISTICHE DEL PRODOTTO
Principio
Questo kit utilizza la sequenza specifica conservata del gene f3L di MPV come regione target. La tecnologia di PCR quantitativa a fluorescenza in tempo reale e la tecnologia di rilascio rapido dell'acido nucleico vengono utilizzate per monitorare l'acido nucleico virale attraverso la variazione del segnale di fluorescenza dei prodotti di amplificazione. Il sistema di rilevamento include un controllo di qualità interno, utilizzato per verificare la presenza di inibitori della PCR nei campioni o se le cellule nei campioni sono state prelevate, il che può prevenire efficacemente la situazione di falsi negativi.
COMPONENTI PRINCIPALI
Il kit contiene reagenti per l'elaborazione di 48 test o per il controllo di qualità, tra cui i seguenti componenti:
Reagente A
| Nome | Componenti principali | Quantità |
| Rilevamento MPV reagente | La provetta di reazione contiene Mg2+, sonda primer gene f3L/RNasi P, tampone di reazione, enzima Taq DNA. | 48 test |
ReagenteB
| Nome | Componenti principali | Quantità |
| Monovolume Controllo positivo | Contenente frammento bersaglio MPV | 1 tubo |
| Monovolume Controllo negativo | Senza frammento bersaglio MPV | 1 tubo |
| Reagente di rilascio del DNA | Il reagente contiene Tris, EDTA e Tritone. | 48 pezzi |
| Reagente di ricostituzione | Acqua trattata con DEPC | 5 ml |
Nota: i componenti di numeri di lotto diversi non possono essere utilizzati in modo intercambiabile
【Condizioni di conservazione e durata di conservazione】
1. Il reagente A/B può essere conservato a una temperatura compresa tra 2 e 30°C e la sua durata è di 10 mesi.
2. Aprire il coperchio della provetta solo quando si è pronti per il test.
3. Non utilizzare le provette oltre la data di scadenza.
4. Non utilizzare un tubo di rilevamento delle perdite.
【Strumento applicabile】
Adatto per Adatto per sistema di analisi PCR LC480, sistema di analisi PCR automatico Gentier 48E, sistema di analisi PCR ABI7500.
【Requisiti campione】
1. Tipi di campioni applicabili: campioni di tamponi faringei.
2. Soluzione di campionamento:Dopo la verifica, si consiglia di utilizzare soluzione fisiologica normale o una provetta per la conservazione dei virus prodotta da Hangzhou Testsea Biology per la raccolta dei campioni.
tampone faringeo:pulire le tonsille faringee bilaterali e la parete faringea posteriore con un tampone di campionamento sterile monouso, immergere il tampone nella provetta contenente 3 ml di soluzione di campionamento, scartare la coda e chiudere bene la copertura della provetta.
3. Conservazione e consegna dei campioni:I campioni da analizzare devono essere analizzati il prima possibile. La temperatura di trasporto deve essere mantenuta tra 2 e 8 °C. I campioni che possono essere analizzati entro 24 ore possono essere conservati a una temperatura tra 2 e 8 °C e, se non possono essere analizzati entro 24 ore, devono essere conservati a una temperatura inferiore o uguale a -70 °C (se non è possibile conservarli a -70 °C, possono essere conservati temporaneamente a -20 °C). Evitare ripetute
congelamento e scongelamento.
4. La corretta raccolta, conservazione e trasporto dei campioni sono essenziali per le prestazioni di questo prodotto.
【Metodo di prova】
1. Elaborazione del campione e aggiunta del campione
1.1 Elaborazione del campione
Dopo aver miscelato la soluzione di campionamento sopra indicata con i campioni, prelevare 30 μL del campione nella provetta del reagente di rilascio del DNA e mescolare uniformemente.
1.2 Caricamento
Prendere 20 μL del reagente di ricostituzione e aggiungerli al reagente di rilevamento MPV, aggiungere 5 μL del campione elaborato sopra (il controllo positivo e il controllo negativo devono essere elaborati parallelamente ai campioni), coprire il tappo della provetta e centrifugare a 2000 giri/min per 10 secondi.
2. Amplificazione PCR
2.1 Caricare la piastra/provette PCR preparate nello strumento PCR a fluorescenza. Per ogni test devono essere impostati il controllo negativo e il controllo positivo.
2.2 Impostazione del canale fluorescente:
1) Scegliere il canale FAM per il rilevamento MPV;
2) Scegliere il canale HEX/VIC per il rilevamento del gene di controllo interno;
3. Analisi dei risultati
Impostare la linea di base sopra il punto più alto della curva fluorescente del controllo negativo.
4. Controllo di qualità
4.1 Controllo negativo: nessun valore Ct rilevato nel canale FAM, HEX/VIC o Ct>40;
4.2 Controllo positivo: nel canale FAM, HEX/VIC, Ct≤40;
4.3 I requisiti di cui sopra devono essere soddisfatti nello stesso esperimento, altrimenti i risultati del test non sono validi e l'esperimento deve essere ripetuto.
【Valore limite】
Un campione è considerato positivo quando: Sequenza target Ct≤40, Gene di controllo interno Ct≤40.
【Interpretazione dei risultati】
Una volta superato il controllo di qualità, gli utenti devono verificare se è presente una curva di amplificazione per ciascun campione nel canale HEX/VIC. In tal caso, e con Ct≤40, significa che il gene di controllo interno è stato amplificato correttamente e che il test è valido. Gli utenti possono procedere all'analisi di follow-up:
3. Per i campioni con amplificazione del gene di controllo interno fallita (HEX/VIC
canale, Ct>40 o nessuna curva di amplificazione), una bassa carica virale o la presenza di un inibitore della PCR potrebbero essere la causa del fallimento, l'esame deve essere ripetuto dalla raccolta del campione;
4. Per i campioni positivi e il virus coltivato, i risultati del controllo interno non influenzano;
Per i campioni risultati negativi, il controllo interno deve essere risultato positivo, altrimenti il risultato complessivo non è valido e l'esame deve essere ripetuto, a partire dalla fase di raccolta del campione.
Informazioni sulla mostra






Profilo Aziendale
Noi, Hangzhou Testsea Biotechnology Co., Ltd, siamo un'azienda biotecnologica professionale in rapida crescita, specializzata nella ricerca, nello sviluppo, nella produzione e nella distribuzione di kit di test diagnostici in vitro (IVD) avanzati e di strumenti medici.
Il nostro stabilimento è certificato GMP, ISO9001 e ISO13458 e abbiamo l'approvazione CE e FDA. Non vediamo l'ora di collaborare con altre aziende estere per uno sviluppo reciproco.
Produciamo test di fertilità, test per malattie infettive, test per abuso di droghe, test per marcatori cardiaci, test per marcatori tumorali, test per alimenti e sicurezza e test per malattie animali. Inoltre, il nostro marchio TESTSEALABS è ben noto sia sul mercato nazionale che estero. La migliore qualità e i prezzi vantaggiosi ci consentono di detenere oltre il 50% delle quote di mercato nazionali.
Processo del prodotto

1. Preparare

2.Copertura

3. Membrana trasversale

4.Tagliare la striscia

5.Assemblaggio

6. Riempi le buste

7. Sigillare le buste

8.Imballa la scatola

9. Rivestimento

Prevenire una nuova tragedia: prepararsi ora alla diffusione del vaiolo delle scimmie
Il 14 agosto, l'Organizzazione Mondiale della Sanità (OMS) ha annunciato che l'epidemia di vaiolo delle scimmie costituisce un'"emergenza di sanità pubblica di interesse internazionale". È la seconda volta che l'OMS emette il livello di allerta più alto per quanto riguarda l'epidemia di vaiolo delle scimmie da luglio 2022.
Attualmente, l'epidemia di vaiolo delle scimmie si è diffusa dall'Africa all'Europa e all'Asia, con casi confermati segnalati in Svezia e Pakistan.
Secondo gli ultimi dati dell'Africa CDC, quest'anno 12 stati membri dell'Unione Africana hanno segnalato un totale di 18.737 casi di vaiolo delle scimmie, di cui 3.101 casi confermati, 15.636 casi sospetti e 541 decessi, con un tasso di mortalità del 2,89%.
01 Che cos'è il vaiolo delle scimmie?
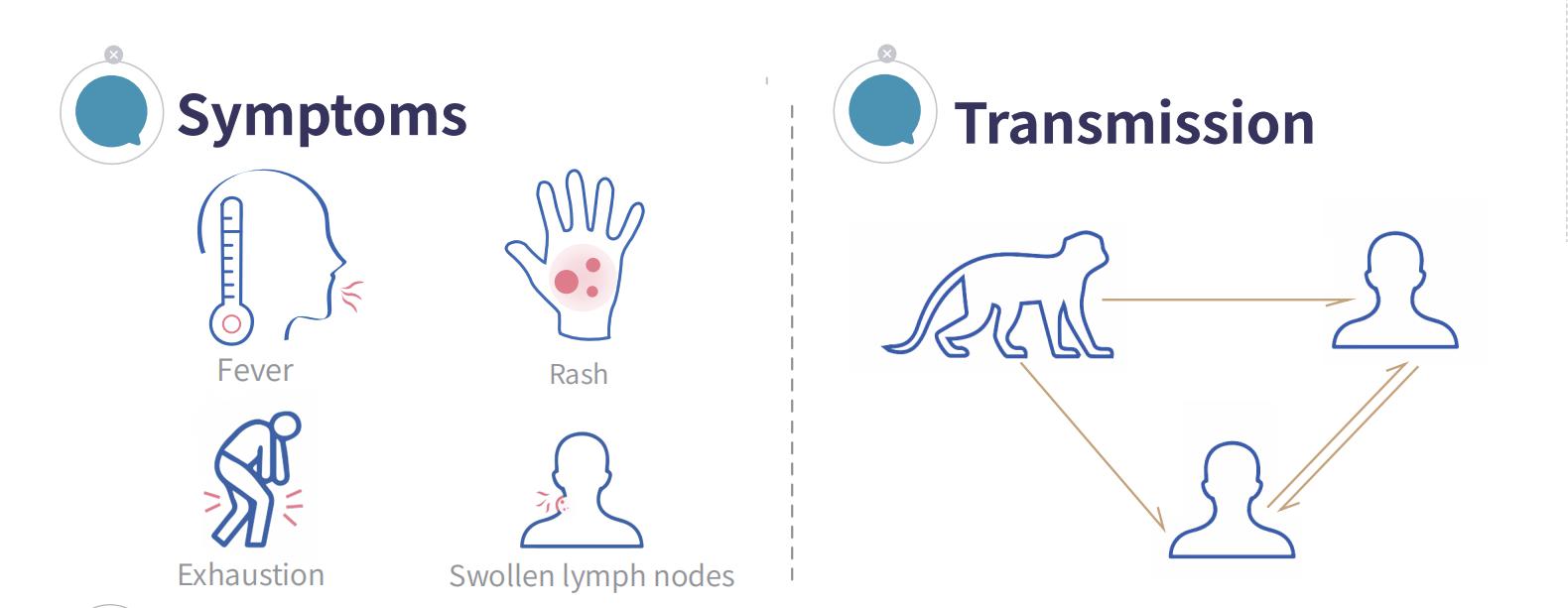
Il vaiolo delle scimmie (MPX) è una zoonosi virale causata dal virus del vaiolo delle scimmie. Può essere trasmessa dagli animali all'uomo, così come tra esseri umani. I sintomi tipici includono febbre, eruzione cutanea e linfoadenopatia.
Il virus del vaiolo delle scimmie penetra nel corpo umano principalmente attraverso le mucose e le lesioni cutanee. Le fonti di infezione includono casi di vaiolo delle scimmie e roditori, scimmie e altri primati non umani infetti. Dopo l'infezione, il periodo di incubazione è compreso tra 5 e 21 giorni, in genere tra 6 e 13 giorni.
Sebbene la popolazione generale sia suscettibile al virus del vaiolo delle scimmie, esiste un certo grado di protezione crociata contro il vaiolo delle scimmie per coloro che sono stati vaccinati contro il vaiolo, grazie alle somiglianze genetiche e antigeniche tra i virus. Attualmente, il vaiolo delle scimmie si diffonde principalmente tra gli uomini che hanno rapporti sessuali con altri uomini, mentre il rischio di infezione per la popolazione generale rimane basso.
02 In che modo questa epidemia di vaiolo delle scimmie è diversa?
Dall'inizio dell'anno, il ceppo principale del virus del vaiolo delle scimmie, il "Clade II", ha causato un'epidemia su larga scala in tutto il mondo. È preoccupante che la percentuale di casi causati dal "Clade I", più grave e con un tasso di mortalità più elevato, sia in aumento e sia stata confermata al di fuori del continente africano. Inoltre, da settembre dello scorso anno, è stata identificata una nuova variante, più letale e facilmente trasmissibile, "Clade Ib," ha iniziato a diffondersi nella Repubblica Democratica del Congo.
Una caratteristica degna di nota di questa epidemia è che le donne e i bambini sotto i 15 anni sono i più colpiti.
I dati mostrano che oltre il 70% dei casi segnalati riguarda pazienti di età inferiore ai 15 anni e, tra i casi fatali, questa cifra sale all'85%. In particolare,il tasso di mortalità tra i bambini è quattro volte superiore a quello degli adulti.
03 Qual è il rischio di trasmissione del vaiolo delle scimmie?
A causa della stagione turistica e delle frequenti interazioni internazionali, il rischio di trasmissione transfrontaliera del virus del vaiolo delle scimmie potrebbe aumentare. Tuttavia, il virus si diffonde principalmente attraverso contatti ravvicinati prolungati, come l'attività sessuale, il contatto cutaneo e la respirazione a distanza ravvicinata o il parlare con altre persone, quindi la sua capacità di trasmissione da persona a persona è relativamente debole.
04 Come prevenire il vaiolo delle scimmie?
Evitare il contatto sessuale con individui il cui stato di salute non sia noto. I viaggiatori devono prestare attenzione alle epidemie di vaiolo delle scimmie nei paesi e nelle regioni di destinazione ed evitare il contatto con roditori e primati.
In caso di comportamenti ad alto rischio, monitorate il vostro stato di salute per 21 giorni ed evitate il contatto ravvicinato con altre persone. Se compaiono sintomi come eruzioni cutanee, vesciche o febbre, consultate immediatamente un medico e informatelo dei comportamenti rilevanti.
Se a un familiare o a un amico viene diagnosticato il vaiolo delle scimmie, adottare misure di protezione individuale, evitare il contatto ravvicinato con il paziente e non toccare oggetti che il paziente ha utilizzato, come vestiti, biancheria da letto, asciugamani e altri effetti personali. Evitare di condividere i bagni, lavarsi spesso le mani e arieggiare gli ambienti.
Reagenti diagnostici per il vaiolo delle scimmie
I reagenti diagnostici per il vaiolo delle scimmie aiutano a confermare l'infezione rilevando antigeni o anticorpi virali, consentendo l'isolamento e le misure di trattamento appropriate e svolgendo un ruolo importante nel controllo delle malattie infettive. Attualmente, Anhui DeepBlue Medical Technology Co., Ltd. ha sviluppato i seguenti reagenti diagnostici per il vaiolo delle scimmie:
Kit per il test dell'antigene del vaiolo delle scimmie: utilizza il metodo dell'oro colloidale per raccogliere campioni come tamponi orofaringei, tamponi nasofaringei o essudati cutanei per la rilevazione. Conferma l'infezione rilevando la presenza di antigeni virali.
Kit per il test degli anticorpi del vaiolo delle scimmie: utilizza il metodo dell'oro colloidale, con campioni che includono sangue intero venoso, plasma o siero. Conferma l'infezione rilevando gli anticorpi prodotti dall'organismo umano o animale contro il virus del vaiolo delle scimmie.
Kit per il test degli acidi nucleici del virus del vaiolo delle scimmie: utilizza il metodo PCR quantitativa fluorescente in tempo reale, utilizzando il campione come essudato della lesione. Conferma l'infezione rilevando il genoma del virus o frammenti genici specifici.
Prodotti per il test del vaiolo delle scimmie di Testsealabs
Dal 2015, i reagenti diagnostici per il vaiolo delle scimmie di Testsealabs sono stati validati utilizzando campioni di virus reali in laboratori stranieri e hanno ottenuto la certificazione CE per le loro prestazioni stabili e affidabili. Questi reagenti sono mirati a diverse tipologie di campione, offrendo diversi livelli di sensibilità e specificità, fornendo un valido supporto per il rilevamento dell'infezione da vaiolo delle scimmie e un supporto migliore per un controllo efficace delle epidemie. Per maggiori informazioni sul nostro kit per il test del vaiolo delle scimmie, consultare: https://www.testsealabs.com/monkeypox-virus-mpv-nucleic-acid-detection-kit-product/
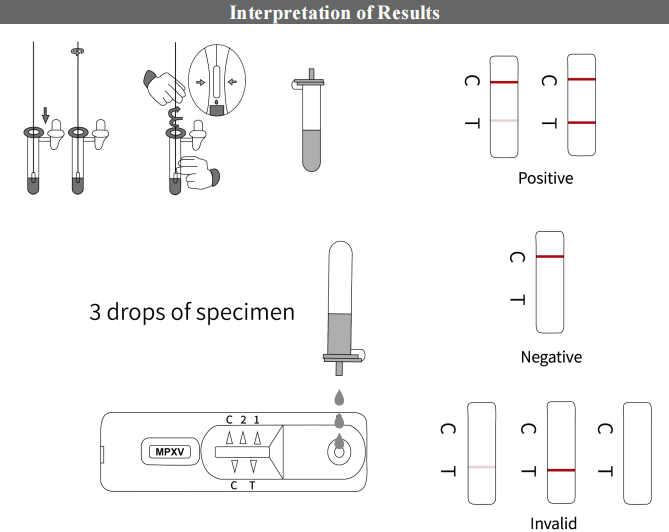
Procedura di test
Utilizzando un tampone per raccogliere il pus dalla pustola, mescolandolo accuratamente neltampone e quindi applicarne alcune gocce sulla scheda di prova. Il risultato può essere ottenuto in pochi semplici passaggi.