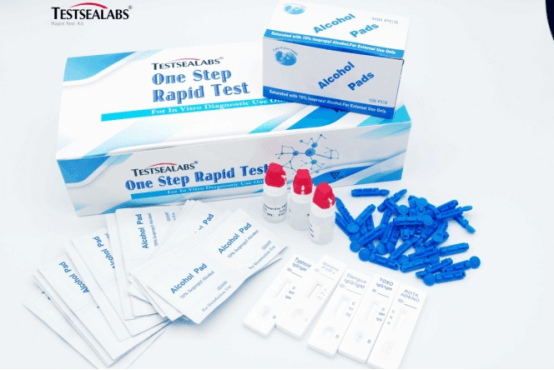
Kit de proba rápida de enfermidades Testsealabs para o anticorpo IgM de Chlamydia pneumoniae
Detalles rápidos
| Nome da marca: | mar de probas | Nome do produto: | Kit de proba rápida de IgM contra Chlamydia pneumoniae |
| Lugar de orixe: | Zhejiang, China | Tipo: | Equipos de análise patolóxica |
| Certificado: | ISO9001/13485 | Clasificación de instrumentos | Clase II |
| Precisión: | 99,6% | Exemplar: | Sangue enteiro/Soro/Plasma |
| Formato: | Casete/Tira | Especificación: | 3,00 mm/4,00 mm |
| MOQ: | 1000 unidades | Vida útil: | 2 anos |

Uso previsto
A proba rápida CP-IgM é un inmunoensaio cromatográfico rápido para a detección cualitativa de anticorpos (IgM) contra a chlamydia pneumoniae en sangue completo/soro/plasma para axudar no diagnóstico da infección viral por chlamydia pneumoniae.

Procedemento de proba
Deixar que a proba, a mostra, o tampón e/ou os controis alcancen unha temperatura ambiente de 15-30 ℃ (59-86 ℉) antes da proba.
1. Deixe que a bolsa alcance a temperatura ambiente antes de abrila. Retire o dispositivo de proba dobolsa selada e úsea canto antes.
2. Coloque o dispositivo de proba sobre unha superficie limpa e nivelada.
3. Para mostras de soro ou plasma: Manteña o contagotas verticalmente e transfira 3 gotas de soro.ou plasma (aproximadamente 100 μl) no pozo(s) da mostra do dispositivo de proba e, a seguir, inicie otemporizador. Vexa a ilustración a continuación.
4. Para mostras de sangue enteiro: Manteña o contagotas verticalmente e transfira 1 gota de sangue enteirosangue (aproximadamente 35 μl) no pozo (S) da mostra do dispositivo de proba, despois engade 2 gotas de tampón (aproximadamente 70 μl) e inicia o temporizador. Consulta a ilustración a continuación.
5. Agarde a que aparezan as liñas de cor. Lea os resultados aos 15 minutos. Non interprete asresultado despois de 20 minutos.
Aplicar unha cantidade suficiente de mostra é esencial para obter un resultado válido da proba. Se a migración (a humidadeda membrana) non se observa na xanela de proba despois dun minuto, engade unha gota máis de tampón(para sangue enteiro) ou mostra (para soro ou plasma) ao pozo de mostra.
Interpretación dos resultados
Positivo:Aparecen dúas liñas. Sempre debe aparecer unha liña na rexión da liña de control (C) edebería aparecer outra liña coloreada aparente na rexión da liña de proba.
Negativo:Aparece unha liña coloreada na rexión de control (C). Non aparece ningunha liña coloreada aparente ena rexión da liña de proba.
Non válido:A liña de control non aparece. Volume de mostra insuficiente ou procedemento incorrecto.As técnicas son as razóns máis probables dos fallos da liña de control.
★ Revisa o procedemento e repitea proba cun novo dispositivo de proba. Se o problema persiste, deixe de usar o kit de proba inmediatamente e póñase en contacto co seu distribuidor local.
Información da exposición






Perfil da empresa
Nós, Hangzhou Testsea Biotechnology Co., Ltd, somos unha empresa de biotecnoloxía profesional en rápido crecemento especializada na investigación, desenvolvemento, fabricación e distribución de kits avanzados de probas de diagnóstico in vitro (IVD) e instrumentos médicos.
As nosas instalacións están certificadas por GMP, ISO9001 e ISO13458 e contamos coa aprobación CE da FDA. Agora agardamos con interese cooperar con máis empresas estranxeiras para o desenvolvemento mutuo.
Producimos probas de fertilidade, probas de enfermidades infecciosas, probas de abuso de drogas, probas de marcadores cardíacos, probas de marcadores tumorais, probas de seguridade alimentaria e probas de enfermidades animais. Ademais, a nosa marca TESTSEALABS é ben coñecida tanto nos mercados nacionais como estranxeiros. A mellor calidade e os prezos favorables permítennos adquirir máis do 50 % das accións nacionais.
Proceso do produto

1. Preparación

2.Cuberta

3. Membrana cruzada

4. Cortar a tira

5. Montaxe

6. Empaqueta as bolsas

7. Selar as bolsas

8. Empaqueta a caixa

9. Revestimento