Kit de prueba de antígeno carcinoembrionario Testsealabs CEA
Tabla de parámetros
| Número de modelo | TSIN101 |
| Nombre | Kit de prueba de alfafetoproteína AFP |
| Características | Alta sensibilidad, simple, fácil y preciso. |
| Muestra | WB/S/P |
| Especificación | 3,0 mm 4,0 mm |
| Exactitud | 99.6% |
| Almacenamiento | 2 °C-30 °C |
| Envío | Por mar/Por aire/TNT/Fedx/DHL |
| Clasificación de instrumentos | Clase II |
| Certificado | CE ISO FSC |
| Duración | dos años |
| Tipo | Equipos de análisis patológico |
Principio del dispositivo de prueba rápida FOB
El dispositivo de prueba rápida de CEA (sangre total/suero/plasma) ha sido diseñado para detectar el antígeno carcinoembrionario humano (CEA) mediante la interpretación visual del desarrollo del color en la tira interna. La membrana se inmovilizó con anticuerpos de captura anti-CEA en la región de prueba. Durante la prueba, la muestra reacciona con anticuerpos monoclonales anti-CEA coloreados y conjugados de oro coloidal, que se recubrieron previamente en la almohadilla de muestra de la prueba. La mezcla se mueve entonces sobre la membrana por capilaridad e interactúa con los reactivos presentes en ella. Si hay suficiente CEA en las muestras, se formará una banda coloreada en la región de prueba de la membrana. La presencia de esta banda coloreada indica un resultado positivo, mientras que su ausencia indica un resultado negativo. La aparición de una banda coloreada en la región de control sirve como control del procedimiento. Esto indica que se ha añadido el volumen adecuado de muestra y que se ha producido la absorción de la membrana.

1. No abra la bolsa de aluminio hasta que esté listo para comenzar la prueba. Los dispositivos de prueba refrigerados deben alcanzar la temperatura ambiente (15-28 °C) antes de abrir la bolsa.
2. Retire el dispositivo de la bolsa protectora y etiquételo con la identificación de la muestra.
3. Agregue 50 ul de sangre fresca al pocillo de muestra (para tarjeta) o la almohadilla de muestra (para tira reactiva). Luego, agregue 2 gotas (50 ul) de solución tampón de prueba en el pocillo de muestra o la almohadilla de muestra.
4. Lea el resultado dentro de 10 a 15 minutos. No lea los resultados después de 15 minutos. Observe
La banda coloreada desarrollada sobre la región de control indica que el ensayo está completo.
Procedimiento de prueba
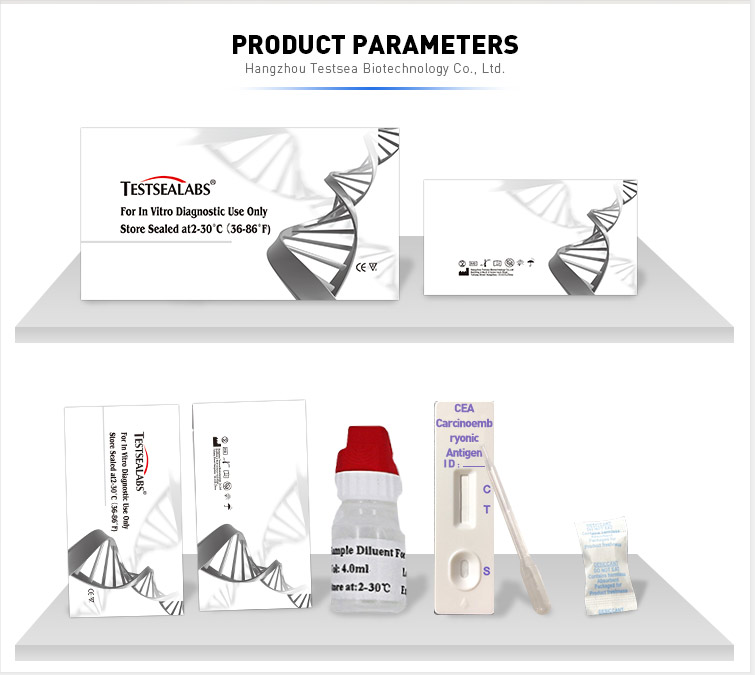
CONTENIDO DEL KIT
1.Dispositivos de prueba empaquetados individualmente
Cada dispositivo contiene una tira con conjugados coloreados y reactivos previamente esparcidos en las regiones correspondientes.
2.pipetas desechables
Para agregar muestras utilice.
3.Buffer
Solución salina tamponada con fosfato y conservante.
4.Prospecto del paquete
Para instrucciones de funcionamiento.
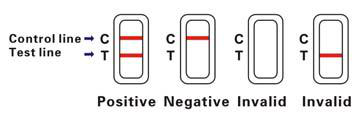
INTERPRETACIÓN DE LOS RESULTADOS
Positivo (+)
Aparecen dos bandas rosas en la región de prueba. Esto indica que la muestra contiene CEA.
Negativo (-)
Solo aparece una banda rosa en la región de prueba. Esto indica que no hay CEA en la sangre completa.
Inválido
Si no aparece una banda de color en la zona de prueba, esto indica un posible error al realizar la prueba. Debe repetirse la prueba con un dispositivo nuevo.
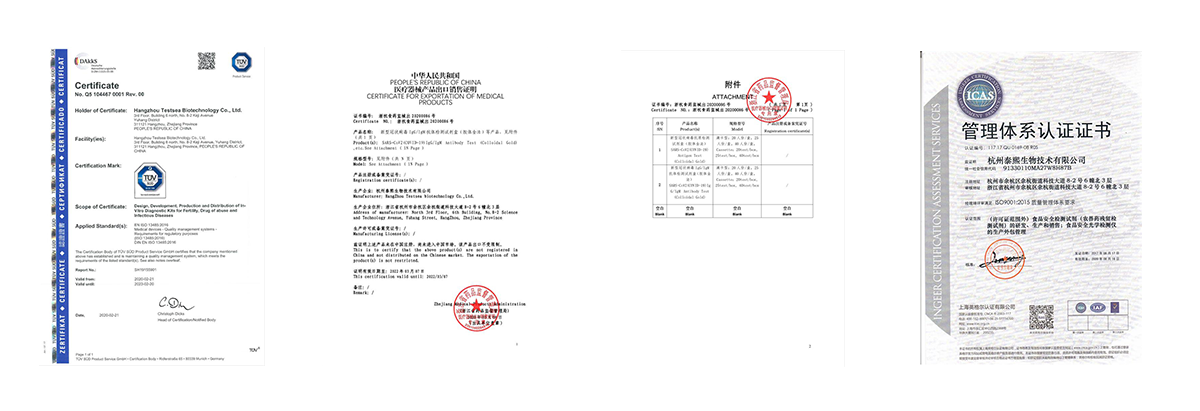
Información de la exposición






Perfil de la empresa
Nosotros, Hangzhou Testsea Biotechnology Co., Ltd, somos una empresa de biotecnología profesional de rápido crecimiento especializada en la investigación, el desarrollo, la fabricación y la distribución de kits de prueba de diagnóstico in vitro (IVD) avanzados e instrumentos médicos.
Nuestras instalaciones cuentan con las certificaciones GMP, ISO9001 e ISO13458, además de la aprobación CE y FDA. Esperamos colaborar con más empresas extranjeras para un desarrollo mutuo.
Fabricamos pruebas de fertilidad, pruebas de enfermedades infecciosas, pruebas de drogodependencia, pruebas de marcadores cardíacos, pruebas de marcadores tumorales, pruebas de seguridad alimentaria y pruebas de enfermedades animales. Además, nuestra marca TESTSEALABS goza de gran reconocimiento tanto en el mercado nacional como en el extranjero. Nuestra excelente calidad y precios competitivos nos permiten controlar más del 50% de la cuota de mercado nacional.
Proceso del producto

1.Preparar

2. Cubierta

3. Membrana cruzada

4.Cortar la tira

5.Montaje

6. Empaque las bolsas

7.Sella las bolsas

8. Empaque la caja

9. Encapsulamiento